Der Zusammenhalt von Atomen und Molekülen ist von verschiedenen Wechselwirkungen bestimmt. Das gilt auch für Atome und Moleküle an der Grenzfläche. Man unterscheidet polare und disperse Wechselwirkungen, welche zusammen die Grenzflächenenergie ergeben. Das Verhältnis von polaren und dispersen Anteilen hat Einfluss auf die Benetzung und Haftung zweier Phasen an der Grenzfläche.
Disperse und polare Wechselwirkungen zwischen Molekülen
Der Zusammenhalt von Atomen und Molekülen, der die Grenzflächenenergie einer Substanz bedingt, ist auf unterschiedliche Arten von Wechselwirkungen zurückzuführen. Hierbei kann zwischen dispersen und polaren Wechselwirkungen unterschieden werden.
Die Wechselwirkungen aufgrund von zeitlichen Fluktuationen der Ladungsverteilung der Atome oder Moleküle werden als disperse oder Van-der-Waals-Wechselwirkungen bezeichnet. Unter polaren Wechselwirkungen werden Coulomb-Wechselwirkungen zwischen permanenten Dipolen und zwischen permanenten und induzierten Dipolen zusammengefasst. Ein Beispiel für polare Wechselwirkungen sind Wasserstoffbrückenbindungen, wie sie zum Beispiel Wassermoleküle ausbilden.
Wie setzt sich die Grenzflächenenergie aus polarem und dispersem Anteil zusammen?
Die Grenzflächenenergie σ kann so verstanden werden, dass sie aus einem dispersen Anteil σd und einem polaren Anteil σp zusammensetzt ist:
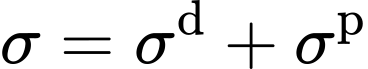
Da disperse Wechselwirkungen bei allen Atomen und Molekülen auftreten, kann es keine Substanz geben, deren Grenzflächenenergie nur einen polaren Anteil besitzt. Andererseits gibt es Substanzen, die keine polaren Gruppen besitzen. Ihre Grenzflächenenergie ist folglich rein dispers. Ein Beispiel sind aus Kohlenwasserstoffketten aufgebaute Alkane.